Después de una sesión de gimnasia, un hombre de 48 años presentó
ataxia repentina, náusea y diplopía seguidas por incapacidad persistente
para ver el cuadrante superior izquierdo de su campo visual, ya sea con
el ojo izquierdo como con el derecho. No tuvo dolor de cuello. Tiene
antecedentes de hipertensión y migrañas con aura. La resonancia
magnética (RM) mostró un infarto occipitotemporal derecho y talámico. La
angiografía por RM mostró un punto de corte brusco de un segmento
distal de la arteria cerebral posterior derecha. El hemograma completo,
el tiempo de protrombina y el tiempo parcial de tromboplastina fueron
normales. Los resultados del ecocardiograma transtorácico sugieren un
posible cortocircuito de derecha a izquierda. La telemetría cardiaca
durante los 2 primeros días de hospitalización no reveló arritmias.
¿Cómo se debe evaluar exhaustivamente a este paciente?
El problema clínico
Los accidentes cerebrovasculares (ACV) isquémicos criptogénicos
(ACV-IC) son infartos cerebrales sintomáticos cuya causa probable no se
identifica después de una evaluación diagnóstica adecuada. El uso de de
definiciones más amplias permite el diagnóstico de más ACV en los
pacientes que fueron evaluados en forma incompleta y en aquellos con más
de una causa probable identificada, pero el autor piensa que es mejor
que estos casos sean considerados como entidades separadas.
Entre los ACV de causa indeterminada es útil establecer más
diferencias entre los ACV que son criptogénicos después de la evaluación
estándar y los que son criptogénicos después de una evaluación
especializada y, entre los que son "altamente criptogénicos" (es decir,
sin ninguna causa posible o probable descubierta) y los "de origen
posiblemente determinado" (es decir, sin causa probable pero con una o
más causas posibles identificadas).
Los mecanismos
criptogénicos representan el 10% al
40% de todos los ACV isquémicos. Este rango es producto de las
diferentes definiciones utilizadas a través de la serie, la evolución de
la tecnología diagnóstica, las diferentes concepciones de la
investigación etiológica adecuada y el hecho de que hay más de 200
causas conocidas de ACV isquémico que sería necesario excluir.
En general, el porcentaje de ACV isquémicos que se clasifican como
criptogénicos ha disminuido con el tiempo a medida que se han ido
perfeccionando las pruebas de diagnóstico, pasando del 40% en la década
de 1970 al 10-15% en la actualidad, en los centros altamente
especializados. Sin embargo, el ACV-IC después de una evaluación
diagnóstica estándar sigue siendo un problema clínico frecuente,
representando el 20-30% de todos los ACV isquémicos.
Las causas determinantes más comunes del ACV isquémico que se identifican durante la evaluación rutinaria inicial son la
aterosclerosis y el cardioembolismo de las grandes arterias y, la enfermedad de los
vasos pequeños, cada una de las cuales es responsable de aproximadamente el 25% de los casos.
A menudo, en los pacientes con diagnóstico presuntivo de ACV-IC
después de la evaluación estándar, la realización de estudios más
especializados permite arribar al diagnóstico etiológico, como la
aterosclerosis oculta, incluyendo las placas no estenosantes pero
inestables en zonas intracraneanas y sitios cervicales o las placas
estenosantes en el tórax y del origen de la carótida común y las
arterias vertebrales torácicas; las arteriopatías no ateroscleróticas
como la disección o la vasculitis; los estados de hipercoagulabilidad;
el cardioembolismo de grado medio como la fibrilación auricular
paroxística de baja carga o la miocardiopatía dilatada de grado moderado
y, la embolia paradójica.
La edad del paciente influye en la probabilidad de las diversas
causas. En los adultos jóvenes de 18 a 30 años es más común la disección
pero la trombofilia congénita y la enfermedad cardíaca también son
causas destacables. En las personas de 31 a 60 años, la aterosclerosis
precoz y la enfermedad cardíaca estructural con baja carga son cada vez
más comunes. En los pacientes >60 años es más frecuente la
fibrilación auricular oculta.
En comparación con los ACV de origen determinado, generalmente los
ACV criptogénicos provocan déficits neurológicos y discapacidad final de
menor gravedad y una mortalidad más baja. En la mayoría pero no en
todos los estudios de seguimiento a largo plazo, los pacientes con
ACV-IC tienen menor riesgo de recurrencia que aquellos con ACV de causa
identificada.
En el estudio a largo plazo más grande realizado hasta la fecha, los
pacientes de 18 a 55 años que sufrieron un ACV-IC y fueron tratados con
aspirina mostraron una tasa de recurrencia del 1,9% en el primer año
después del ACV, y del 0,8%/año a los 2 a 4 años. Esta tasa baja de
recurrencia concuerda con la ausencia de una causa fácilmente
identificable de ACV mayor que colocaría al paciente en un riesgo
elevado.
Puntos clínicos clave
ACV criptogénico
• En la cuarta parte de los pacientes con ACV isquémico no se
halla ninguna causa probable después de la evaluación estándar,
incluyendo la ecocardiografía, la telemetría cardiaca o el Holter de 24
horas en los pacientes hospitalizados, las imágenes por RM o TC para ver
las características topográficas del infarto cerebral y, la TC
angiográfica de las arterias del cuello y el cerebro. La investigación
adicional identifica el mecanismo probable en más de la mitad de estos
pacientes.
• La mayoría de los ACV-IC se produce por émbolos que se originan
en las arterias proximales, el corazón o las venas (si hay cortocircuito
de derecha a izquierda).
• El estudio de los pacientes con ACV-IC incluye la evaluación de
las arteriopatías ateroscleróticas y no ateroscleróticas, el origen
cardíaco de de las embolias (anormalidades estructurales y arritmias) y,
los trastornos de la coagulación.
• El foramen oval permeable se encuentra hasta en la mitad de los
adultos jóvenes con ACV-IC, pero también se halla en la cuarta parte de
las personas sanas.
• La fibrilación auricular paroxística oculta de baja carga se
reconoce cada vez más como causa de ACV criptogénico, especialmente en
los pacientes de edad avanzada
|
Estrategias y evidencia
Evaluación del paciente con accidente cerebrovascular isquémico criptogénico
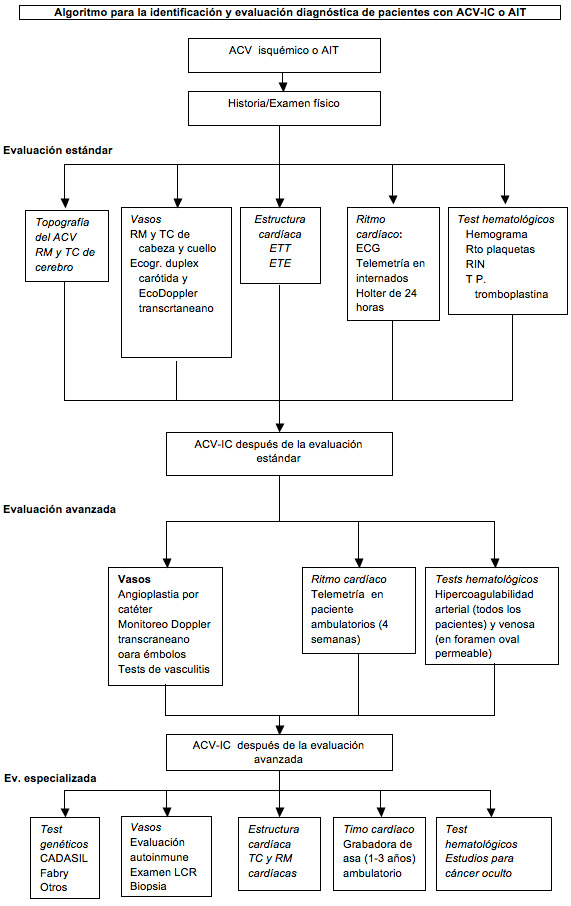
El ACV-IC es un diagnóstico de exclusión
al que se arriba descartando las causas conocidas. En la práctica
actual, la evaluación de rutina del paciente con ACV isquémico tiene
varios componentes. Las características topográficas del ACV
(localización y volumen del infarto y su multiplicidad) se evalúan
mediante la RM cerebral, incluyendo las secuencias de difusión (que son
más sensibles para las lesiones pequeñas y del tronco cerebral y
cerebelo) o la tomografía computarizada (TC) del cerebro (si no se
dispone de la RM).
Las características topográficas
proporcionan importantes pistas etiológicas: la presencia de infartos en
varios territorios sugiere émbolos de un origen aortocardíaco proximal;
los infartos de diferente antigüedad en un solo territorio sugieren
émbolos de origen arterial; los infartos a lo largo de los límites del
territorio de la arteria cerebral hacen sospechar una hipotensión
sistémica o la embolia múltiple y, un infarto pequeño y profundo junto
con imágenes hiperintensas en la sustancia blanca sugiere una enfermedad
intrínseca de los pequeños vasos. Las arterias del cerebro, el cuello y
el tórax se evalúan por angiografía por RM o TC (cuyas sensibilidad y
especificidad son similares) o, si éstas están contraindicadas o no
están disponibles se puede recurrir a la ecografía dúplex carotídea y a
la ecografía Doppler transcraneana.
La presencia de una enfermedad cardíaca
estructural se evalúa mediante la ecocardiografía. El ecocardiograma
transtorácico (ETT) permite visualizar mejor el ventrículo y se utiliza
para el estudio de los pacientes con enfermedad arterial coronaria,
insuficiencia cardíaca u otra enfermedad ventricular detectada por la
historia o el electrocardiograma (ECG).
En los pacientes con infarto no lacunar sin
evidencia de enfermedad ventricular, la ecocardiografía transesofágica
(ETE) permite ver bien la aurícula y el arco aórtico se prefiere como
estudio adicional en los pacientes con resultados poco reveladores en la
ETT. La ETE identifica a las anomalías potencialmente más destacadas en
aproximadamente el 50-75% de los pacientes jóvenes con ACV-IC,
incluyendo el foramen oval permeable, el aneurisma del septo
interauricular, la endocarditis, la aterosclerosis aórtica, la
disfunción de la pared miocárdica regional, la dilatación de la aurícula
izquierda y los trombos de la orejuela auricular.
Las arritmias cardíacas
son evaluadas inicialmente mediante el ECG de 12 derivaciones y la
telemetría cardiaca o el monitoreo Holter de 24 horas se utilizan para
los pacientes hospitalizados. Los trastornos hematológicos se estudian
mediante el hemograma, el tiempo de protrombina y el tiempo de parcial
de tromboplastina
Hallazgos sugestivos en la historia y la semiología de los pacientes con ACV-IC
|
Variable
|
Consecuencias clínicas potenciales
|
Características de la historia
|
|
Trauma o manipulación del cuello
|
Disección de la carótida o de la arteria vertebral
|
Migraña
|
Infarto migrañoso o CADASIL*
|
Uso de drogas intravenosas
|
Endocarditis, infección por VIH, vasculitis, embolia paradójica o vasoespasmo
|
Procedimiento dental o infección bacteriana sistémica
|
Endocarditis, embolia séptica o coagulopatía
|
Viaje en avión o maniobra de Valsalva al comienzo del ACV
|
Embolismo paradójico
|
Historia familiar de infarto de miocardio precoz o de ACV isquémico
|
Arteriosclerosis genética acelerada
|
Embarazo o periparto
|
Trombosis venosa cerebral o eclampsia
|
Anemia de células falciformes
|
Enfermedad moyamoya secundaria
|
Signos físicos
|
|
Presión arterial asimétrica en los brazos
|
Coartación de aorta, disección aórtica, enfermedad de Takayasu o aterosclerosis prematura
|
Piel
Marcas de pinchazos
Livedo reticularis
Xantoma o xantelasma
|
Uso de drogas intravenosas, infección por VIH
Síndrome de Sneddon, síndrome de anticuerpos antifosfolípidos o lupus eritematoso sistémico
HIperlipidemia
|
Adenopatía
|
Infección, sarcoidosis o enfermedad de Tangier
|
Soplo cardíaco
|
Endocarditis, defecto septal o mixoma
|
Vasos
Pulsos disminuídos
Soplo
Trombosis venos de las piernas
|
Aterosclerosis prematura, coartación aórtica, disección aórtica o enfermedad de Takayasu
Aterosclerosis precoz, displasia fibromuscular o disección aterosclerosis precoz, displasia arterial
Estado de hipercoagulabilidad
|
*CADASIL: denota la
arteriopatía cerebral autosómica dominante con infartos subcorticales y
leucoencefalopatía, y el virus de la inmunodeficiencia humana VIH
|
| El ACV puede ser
considerado como criptogénico cuando la evaluación clínica estándar y
las imágenes cerebrales sugieren un infarto grande, profundo o
superficial, pero sin hallazgos en las imágenes cardiacas o con análisis
hematológicos que no revelan una causa probable. |
Los pacientes con un infarto profundo y pequeño también pueden ser
considerados portadores de un ACV-IC si son menores de 50 años, no
tienen ningún factor de riesgo vascular estándar, ni hiperintensidades
en la sustancia blanca, o si previamente no han sufrido infartos
pequeños y profundos. Seguidamente, se harán estudios diagnósticos más
especializados.
Para clasificar los ACV isquémicos en los ACV que tienen una causa
conocida o los ACV que son criptogénicos se han desarrollado varios
algoritmos de diagnósticos. El Trial of Org 10172 en el algoritmo
diagnóstico Acute Stroke Treatment (TOAST) está siendo superado por el
ASCOD (Atherosclerosis, Small-vessel disease, Cardiac, Other,
Dissection: aterosclerosis, enfermedad de los vasos pequeños, cardiaco,
otros, disección), más nuevo, y el sistema Causative Clasification of
Stroke (CCS) que tienen un enfoque más graduado cuando son varias las
causas que se identifican.
En comparación con el TOAST, tanto el ASCOD como los sistemas CCS
identifican a un menor número de pacientes con diagnóstico de ACV-IC.
Estos instrumentos son esenciales para la clasificación de los pacientes
en los ensayos clínicos y pueden ser útiles en la práctica clínica.
Esta revisión solo está enfocada en las causas de ACV-IC que
actualmente despiertan mayor interés como la fibrilación auricular
oculta, el foramen oval permeable y la embolia cerebral de origen
indeterminado.
|
Algoritmo para la identificación y evaluación diagnóstica de pacientes con ACV-IC o AIT
|
Fibrilación auricular oculta
La fibrilación auricular manifiesta es una
causa común
del ACV isquémico, el que representa a la cuarta parte de todos los
infartos cerebrales y a más de la mitad de los infartos de origen
cardioembólico. En la evaluación estándar del ACV isquémico, casi el 15%
de los pacientes tiene una historia conocida de fibrilación auricular
crónica o paroxística previa al ACV; casi el 8% recibe el diagnóstico de
fibrilación auricular de reciente comienzo por los hallazgos del primer
ECG y otro 5% recibe el diagnóstico de fibrilación auricular de
reciente comienzo después de la presentación inicial con ritmo sinusal
por los resultados de la telemetría cardiaca o el monitoreo Holter de 24
horas realizados en los pacientes hospitalizados,
La tecnología para detectar la fibrilación auricular paroxística
infrecuente ha mejorado notablemente en los últimos 10 años debido al
desarrollo de los sistemas de telemetría cardíaca móvil que pueden ser
usados externamente durante 2 a 4 semanas, los grabadores de asa
subcutáneos que tienen una batería de larga duración que permite
detectar la fibrilación durante 1 a 3 años y, en los pacientes que
necesitan marcapasos internos terapéuticos o desfibriladores,
dispositivos terapéuticos implantables con capacidad para detectar la
fibrilación auricular durante ≥3 años.
Estos avances tecnológicos pusieron de manifiesto a un grupo de
pacientes con fibrilación auricular paroxística de baja carga muy
sospechados pero pocas veces identificados. Los pacientes con
fibrilación auricular paroxística de baja carga tienen menor riesgo de
ACV que los pacientes con fibrilación auricular crónica o paroxística de
alta carga. Sin embargo, el riesgo de ACV es mayor que entre las
personas sin fibrilación auricular. La ocurrencia de tan solo un
episodio de una hora de fibrilación auricular en 2 años de seguimiento
se ha asociado a una duplicación del riesgo de ACV. Isquémico.
En el 15% de los pacientes cuyos ACV isquémicos se consideran
criptogénicos después de la evaluación convencional realizada durante su
hospitalización, el monitoreo cardíaco ambulatorio prolongado detecta
la fibrilación auricular de baja carga. En el estudio multicéntrico
Cryptogenic Stroke and Underlying AF (CRYSTAL AF), la frecuencia de la
detección de la fibrilación auricular paroxística fue del 9% a los 6
meses; 12% al año y 30% a los 3 años.
Las características de los pacientes que tienen mayor probabilidad de
que la vigilancia prolongada descubra la fibrilación auricular de baja
carga son la edad avanzada y el puntaje más elevado del CHA2DS2-VASc (en
el que los puntajes van del 0 al 9; los puntajes más elevados indican
mayor riesgo), las características topográficas del infarto cerebral
(tales como la afectación de varios territorios vasculares y la
ubicación cortical) y los índices de cardiopatía auricular izquierda,
incluyendo la dilatación de la aurícula izquierda, la deformación y la
reducción de la fracción de vaciado, el tamaño de la orejuela auricular
izquierda, la dispersión de la onda P en el ECG, las extrasístoles
auriculares frecuentes y los niveles del N-terminal pro-péptido
natriurético cerebral elevado en el suero.
Actualmente se desconoce si los pacientes con fibrilación auricular
de baja carga se tratan mejor con anticoagulantes o con agentes
antiplaquetarios. En algunos, es probable que la fibrilación auricular
infrecuente no sea una causa relacionada con el ACV; hay pocos ensayos
clínicos que ayuden a tomar decisiones. Un ensayo aleatorizado reciente
de personas con desfibriladores implantados no mostró una reducción
significativa de un resultado compuesto por ACV, embolia sistémica y
hemorragia grave, utilizando la detección de la fibrilación o el aleteo
auricular oculto para guiar la indicación de warfarina, en comparación
con la atención clínica de rutina.
Sin embargo, algunos pacientes tenían antecedentes de isquemia
cerebral, muchos del grupo de control recibieron anticoagulantes y la
warfarina fue suspendida en el grupo de seguimiento después de períodos
de 1 a 3 meses sin fibrilación auricular. A la espera de la finalización
de ensayos en curso se ha sugerido un algoritmo provisorio.
Foramen oval permeable
El
embolismo paradójico es el pasaje de un coágulo u
otra partícula embólica de la circulación venosa a la circulación
arterial, a través de un cortocircuito de derecha a izquierda, como
sucede en el defecto del tabique auricular o ventricular y en la
malformación arteriovenosa pulmonar. La causa más común de este defecto
es el foramen oval permeable. Esta comunicación interauricular se cierra
normalmente dentro de los 3 meses posteriores al nacimiento, pero puede
persistir durante toda la vida y potencialmente permite la
tromboembolia venosa evitando el pasaje de los émbolos a los vasos
pulmonares y su introducción en la circulación arterial sistémica.
El diámetro medio de un foramen oval permeable es de 4,9 mm, que es
más que suficiente para permitir el paso de émbolos que son lo
suficientemente grandes como para ocluir el tronco de la arteria
cerebral media (3 mm) y las ramas corticales principales (1 mm). El
aneurisma del septo auricular─un tabique interauricular hipermóvil que
sobresale alternativamente en ambas aurículas─es una anormalidad
relacionada que ha sido asociada a un riesgo mayor de ACV en los
pacientes con un foramen oval permeable.
El foramen oval permeable está presente en aproximadamente la cuarta
parte de la población general pero en la mitad de los pacientes con
ACV-IC. Un análisis del riesgo atribuible Bayesiano de los datos
agrupados de 12 estudios sugiere que en los pacientes con ACV-IC que
tenían un foramen oval permeable, dicha cardiopatía probablemente esté
relacionada causalmente con el ACV en casi la mitad de los casos.
Las características que aumentan la probabilidad de una relación
causal son la edad más joven; la maniobra de Valsalva al comienzo del
ACV; el viaje prolongado en avión o en automóvil antes del ACV; la
trombosis venosa concomitante en la pierna o la pelvis; el estado de
hipercoagulabilidad venosa concomitante; la coexistencia de un aneurisma
del septo auricular; el antecedente de migraña con aura; la ubicación
cortical, la multiplicidad y gran tamaño de los infartos cerebrales y,
la ausencia de hipertensión, diabetes y tabaquismo.
El diagnóstico de foramen oval permeable se basa en la ecografía con
sustancia de contraste salino agitada ("burbuja"). La ETT detecta
aproximadamente solo la mitad de los casos de foramen oval permeable
hallados en la ETE o la ecografía Doppler transcraneana. La ecografía
Doppler no brinda información simultánea sobre otras lesiones cardiacas
estructurales y la aterosclerosis del arco aórtico. En consecuencia, el
método preferencial es la ETE.
Cuando existen contraindicaciones para la ETE y la ETT si es poco
reveladora, se utiliza la ecogrrafía Doppler transcraneana con material
de contraste en burbujas. En los pacientes con un foramen oval
permeable, la evidencia de que puede estar relacionado causalmente con
el ACV puede obtenerse mediante otros estudios como el estado de
hipercoagulabilidad venosa y la detección de trombos venosos profundos
ocultos, utilizando la ecografía de las piernas y la RM o la TC de la
pelvis.
Una opción terapéutica de primera línea para los pacientes con ACV-IC
que tienen un foramen oval permeable es el uso de antiplaquetarios; la
administración de 300 mg/día de aspirina en estos pacientes se asocia
con tasas bajas de ACV recurrente. El metaanálisis de datos de
observación y ensayos aleatorizados muestra que la warfarina tiene una
eficacia similar o mayor que la aspirina, especialmente en los pacientes
con infartos en territorios superficiales. Los anticoagulantes directos
orales más nuevos no han sido probados formalmente en los pacientes con
foramen oval permeable, pero su eficacia para la prevención y el
tratamiento del tromboembolismo venoso sugiere un posible beneficio en
la embolia paradójica.
La colocación endovascular percutánea de dispositivos de cierre puede
corregir el foramen oval permeable. Las complicaciones, aunque menos
frecuentes con los nuevos dispositivos de disco que con los más antiguos
con cierre paraguas, incluyen la fibrilación auricular (en casi el 0,7%
pacientes/año) y la embolización del dispositivo durante la
intervención; el taponamiento cardíaco y el hematoma femoral (cada uno
ocurre en <0,5% de los participantes de los ensayos clínicos).
Tres ensayos aleatorizados (uno utilizó un dispositivo de cierre
paraguas y los otros dos utilizaron un dispositivo de cierre disco) no
mostraron tasas significativamente menores de ACV isquémico recurrente
con el tratamiento con dispositivo comparado con el tratamiento médico
solo. Sin embargo, un análisis posterior de datos agrupados de pacientes
individuales mostró una reducción significativa del riesgo de ACV
isquémico recurrente con el dispositivo de cierre disco, de casi 6 a
aproximadamente 2 ACV cada 100 pacientes tratados durante un período de 5
años.
Accidente cerebrovascular embólico de origen indeterminado
Los ACV-IC superficiales o profundos pero grandes casi siempre se
deben a émbolos que llegan al cerebro originados en una arteria, el
corazón o transcardíacos. Entre las causas poco comunes se hallan las
enfermedades intrínsecas de las grandes arterias como la trombosis in
situ o el vasoespasmo. Recientemente, este concepto clínico largamente
establecido fue redefinido como "ACV embólico de origen indeterminado."
Estos ACV embólicos de origen indeterminado son operacionalmente
definidos como infartos cerebrales no lacunares sin estenosis arterial
proximal importante ni origen cardioembólico mayor y representan el
80-90% de todos ACV-IC.
Los infartos hallados en los ACV embólicos de origen indeterminado
provienen de diversos orígenes de bajo riesgo como la disfunción
ventricular izquierda leve, la calcificación del anillo mitral, la
fibrilación auricular paroxística de baja carga, el foramen oval
permeable, la aterosclerosis del arco aórtico y las placas
ateroscleróticas no estenosantes en las arterias cervicales e
intracraneanas.
El beneficio relativo de la anticoagulación versus el tratamiento
antiplaquetario no ha sido bien establecido para cualquiera de estas
entidades. Se están haciendo grandes ensayos internacionales para
comparar los anticoagulantes orales directos nuevos con la aspirina en
los pacientes con un ACV de origen indeterminado. A la espera de su
finalización es razonable iniciar el tratamiento ya sea con agentes
antiplaquetarios o con anticoagulantes orales directos, mientras se
continúan los estudios más detallados para hallar su etiología.
Áreas de incertidumbre
A menudo, en los pacientes con ACV-IC se hacen estudios más
especializados y costosos que dejan poco rendimiento. Aun no se ha
estudiado bien cuál es el enfoque más rentable para su evaluación y cuál
es la utilidad de los estudios muy especializados. Se desconoce cuál es
la duración más eficaz del monitoreo ambulatorio de la fibrilación
auricular de baja carga. La continuación de los estudios para hallar la
etiología no debe retrasar el inicio de un plan de tratamiento
razonable.
Los estudios adicionales son necesarios para ayudar a los médicos a
discriminar si la fibrilación auricular paroxística de baja carga tiene
una relación probable con el ACV o es meramente incidental. Para estimar
la probabilidad de que el foramen oval permeable sea la causa del
ACV-IC se ha desarrollado un puntaje de riesgo pero su potencial para
guiar la terapia requiere datos de estudios adicionales. Se necesitan
datos de ensayos clínicos rigurosos que comparen los resultados del
tratamiento antiplaquetario con el anticoagulante en los pacientes con
ACV embólico de origen indeterminado y en los pacientes con fibrilación
auricular oculta. También se requieren datos de otros ensayos que
comparen los antiplaquetarios, los anticoagulantes y los tratamientos
con dispositivos en los pacientes cuyo ACV-IC haya sido atribuido al
foramen oval permeable.
Guías
La American Heart Association–American Stroke Association y la
American Academy of Neurology–ha publicado guías para el diagnóstico del
ACV isquémico y el tratamiento del ACV-IC.
Conclusiones y recomendaciones
El paciente del caso aquí presentado presenta un ACV atribuible a un
émbolo que ocluyó brevemente la arteria basilar y luego se trasladó
hasta ocluir en forma persistente una rama de la arteria cerebral
posterior derecha. Este caso de un ACV embólico de origen aún no
determinado permite hacer consideraciones etiológicas que incluyen la
aterosclerosis del arco aórtico, el foramen oval permeable con aneurisma
del septo auricular, la fibrilación auricular oculta y los estados
protrombóticos.
El autor propone proseguir los estudios del paciente con un ETE, los
análisis de laboratorio para la hipercoagulabilidad arterial y, debido a
un posible cortocircuito de derecha a izquierda en la ETT, agregar el
análisis de laboratorio para evaluar la hipercoagulabilidad venosa junto
con un plan de monitoreo cardíaco ambulatorio de 4 semanas. Su
hipertensión debe ser controlada, y para el tratamiento antitrombótico,
el autor propone la aspirina, a la espera de los resultados de los
exámenes adicionales para así elegir el tratamiento antiplaquetario o
anticoagulante a largo plazo adecuado.
*Traducción y resumen objetivo: Dra. Marta Papponetti